Likit Biyopsi
Kan, dolaşımdaki hücreler, trombositler, hücre dışı kesecikler, mRNA, miRNA, protein ve hücresiz DNA ( cfDNA ) gibi birçok biyolojik materyal türünü içermektedir (Sollott, 2017). Kanser hastalarının kanındaki, cfDNA’nın (dolaşımdaki tümör DNA’sı (ctDNA)) bir kısmı tümör hücreleri tarafından apoptoz, nekroz veya aktif salım yoluyla salınmaktadır (Stroun vd., 2001). ctDNA dizisindeki tümöre özgü mutasyonlar, yeni bir biyobelirteç türü olarak kullanılabilir. Vücuttaki bu ctDNA dizisini kullanılarak yapılan teste likit biyopsi denilmektedir.
Doku biyopsisi kullanılarak yapılan geleneksel kanser teşhisi ile karşılaştırıldığında, likit biyopsi daha uygulanabilir, girişimsel olmayan ve tümör heterojenliğini değerlendirmek için doku biyopsisinden daha kapsamlıdır. Çünkü, farklı doku/organ kanserleri farklı oranlarda da olsa kana ctDNA salmaktadır (Siena vd., 2018). Ancak dolaşımda çok düşük oranlarda bulunan bu varyantlar her zaman bu yöntemle de tespit edilememektedir. Bu anlamda solid doku ile birlikte periferik kan moleküler genetik sonuçlarını birlikte değerlendirmek ciddi avantajlar sağlamaktadır.
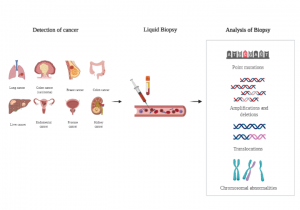
Likit biyopsi, kanser tarama ve tedavisinin farklı aşamalarında uygulanabilen güçlü bir tekniktir. Akciğer kanseri, meme kanseri, kolon kanseri ve mide kanseri gibi birçok kanser türlerinde kullanılabilmektedir. Asemptomatik kanser popülasyonları arasında, erken tanı ve daha iyi müdahale için kullanılabilmektedir (Lindforss vd., 2005). Kanser teşhisinden sonra, hastaların tümöre özgü moleküler profilinin hassas tıp için hedefe yönelik tedaviye rehberlik etmesini sağlamaktadır. Kanser tedavisi sonrası, başarılı bir tedavi sonrasında bile, nüks etme ihtimali hala birçok kanser hastası için önemli bir tehdittir. Görüntüleme veya doku biyopsisi kullanarak zamanında tespit etmek her zaman mümkün olmadığından, (Reinert vd., 2016) likit biyopsi yöntemi ile bu durum erken dönemde tespit edilebilmektedir.
Kaynaklar
1. Lindforss, U., Zetterquist, H., Papadogiannakis, N., Olivecrona, H. 2005. “Persistence of K-ras mutations in plasma after colorectal tumor resection”. Anticancer Research, 25(1 B), 657–661.
2. Reinert, T., Schøler, L. V., Thomsen, R., Tobiasen, H., Vang,S., Nordentoft, I., … Andersen, C. L. 2016. “Analysis of circulatingtumour DNA to monitor disease burden following colorectal cancer surgery”. Gut, 65(4), 625–634.
3. Siena, S., Sartore-Bianchi, A., Garcia-Carbonero, R., Karthaus, M., Smith, D., Tabernero, J., … Bardelli, A. 2018. “Dynamic molecular analysis and clinical correlates of tumor evolution within a phase II trial of panitumumab-based therapy in metastatic colorectal cancer”. Annals of Oncology, 29(1), 119–126.
4. Sollott, M. A. A. S. C. M. J. and; S. J. 2017. “乳鼠心肌提取 HHS Public Access”. Physiology & behavior, 176(3), 139–148.
5. Stroun, M., Lyautey, J., Lederrey, C., Olson-Sand, A., Anker, P. 2001. “About thepossible origin and mechanism of circulating DNA: Apoptosis and active DNA release”. Clinica Chimica Acta, 313(1–2), 139–142.

